 [Startseite] → [Projekte] → [Schwimmender Haarstern]
[Startseite] → [Projekte] → [Schwimmender Haarstern]
Die Idee zu diesem Werk kam mir auf meiner ersten Expedition in die Antarktis. Bei einem Tauchgang mit unserem ferngesteuerten Unterwasserroboter sah ich diese mir bis dahin unbekannten Lebewesen vom Meeresboden aufsteigen und mit anmutigen, aber auf den ersten Blick verwirrenden Bewegungen, davonschwimmen. Seit diesem Moment bin ich von den Haarsternen fasziniert und entschied, mich diesem Thema in einer Doktorarbeit zu widmen. Weil dies im Rahmen meiner Anstellung am Alfred-Wegener-Institut nicht möglich war, beschloss ich, einen langen und steinigen Weg zu gehen, um das Thema berufsbegleitend und auf eigene Faust anzugehen. Da es ohne die Infrastruktur einer Universität oder eines Instituts nicht viele Möglichkeiten gibt, ein solches Projekt zu realisieren, basiert diese Arbeit weitestgehend auf computergestützten Hilfsmitteln, weshalb ich zunächst eine kleine Workstation für den Heimgebrauch gebaut habe. Ich hätte nie gedacht, dass ich es nach fünf Jahren und vielen Entbehrungen endlich geschafft habe und die Urkunde in meinen Händen halte. Dennoch möchte ich nicht unerwähnt lassen, dass ich diesen Erfolg einer ganzen Reihe von Menschen, die mich in dieser Zeit unterstützt haben, verdanke. Vielen herzlichen Dank dafür, ich weiß das wirklich sehr zu schätzen.
A computational approach of locomotion, energy demand, and dispersal of the common comatulid crinoid Promachocrinus kerguelensis (Echinodermata) and its circum-Antarctic success, Veröffentlicht an der Universität Oldenburg Download und in den Berichte zur Polar- und Meeresforschung Download

3D-Modell des antarktischen Kontinents basierend auf Daten der Karte The International Bathymetric Chart of the Southern Ocean (IBCSO) Version 1.0.[1] Es zeigt die bis heute bekannten Orte, an denen die Haarsterne Promachocrinus kerguelensis gefunden worden sind. Das Hintergrundbild eines antarktischen Sonnenuntergangs wurde von Nils Owsianowski aufgenommen.
Ein computergestützter Ansatz der Fortbewegung, dem Energiebedarf und der Ausbreitung des comatulid Crinoidens Promachocrinus kerguelensis (Echinodermata) und seinem zirkumantarktischen Erfolgs
Crinoiden existieren fast unverändert seit mehr als vierhundert Millionen Jahren.[2] Sie sind in allen Ozeanen, von den Tropen[3] bis zu den Polarregionen,[4] zu finden und kommen sowohl in flachen Küstengewässern als auch in der Tiefsee vor.[5][6][7] Es werden zwei Haupttypen unterschieden: Gestielte Crinoiden (Seelilien) und ihre jüngeren Familienmitglieder, die stiellosen Comatuliden (Haarsterne). Mit dem Verlust ihres Stiels erlangten sie eine freie Lebensweise, die mit einer eingeschränkten Schwimmfähigkeit einhergeht, was wahrscheinlich zu einer deutlichen Dominanz von Comatuliden geführt hat.[8][9][10] Unter ihnen ist Promachocrinus kerguelensis die am häufigsten vorkommende Art im Südpolarmeer, dem Kontinentalschelf der Antarktis und den subantarktischen Inseln.[4][5] Obwohl die ökologische Bedeutung von P. kerguelensis nicht vollständig verstanden ist, sind sie häufig Teil der benthischen Gemeinschaften, welche perfekt an die vorherrschenden extremen Umweltbedingungen angepasst sind.
Im Rahmen dieser Arbeit habe ich einen numerischen Ansatz aufgestellt, um die Schwimmfähigkeit von P. kerguelensis in Hinblick auf ihr zirkumantarktisches Vorkommen, ihre Migration sowie die Mechanismen, die zu ihrer weiten Ausbreitung geführt haben, zu bewerten, beides mit Blick auf den Vorteil ihrer Fähigkeit zur aktiven Fortbewegung und der Drift als Plankton während ihres ontogenetischen Larvenstadiums.
Der erste Teil dieser Studie befasst sich mit einer umfänglichen Lokomotionsanalyse von P. kerguelensis. Ein idealisiertes Berechnungsmodell eines schwimmenden Comatuliden (Vid. 3) wurde aus Messungen an Crinoidenproben (Abb. 1) und von Videoaufnahmen abgeleitet (Vid. 1 & Vid. 2). Mithilfe einer analytischen Strömungs- und inversen Dynamik wurden die Schwimmgeschwindigkeit und der entsprechende Energiebedarf zur Fortbewegung bestimmt. Aus deren gegenseitiger Abhängigkeit konnte anschließend die energieeffizienteste Geschwindigkeit, die Maximum Range Velocity (MRV), abgeleitet werden. Im zweiten Teil dieser Arbeit wird ein Migrations- und Ausbreitungsmodell zur Analyse von P. kerguelensis’ zirkumantarktischem Erfolg berechnet. Das Modell basiert auf ihren Schwimmleistung, ihrer pelagischen Lebensphase als Plankton, ihrem energetischen Grundbedarf, verfügbarer Nahrung als Energiequelle und den Meeres- sowie Gezeitenströmungen.
Video 1: ROV-Aufnahme eines schwimmenden Crinoiden P. kerguelensis, aufgenommen im antarktischen Weddellmeer in einer Tiefe von etwa 280 m.[11]
Video 2: Splineinterpolierte Schwimmbewegung der Arme verdeutlicht ihren Paddelschlag und lässt das Bewegungsmuster besser erkennen.[11]
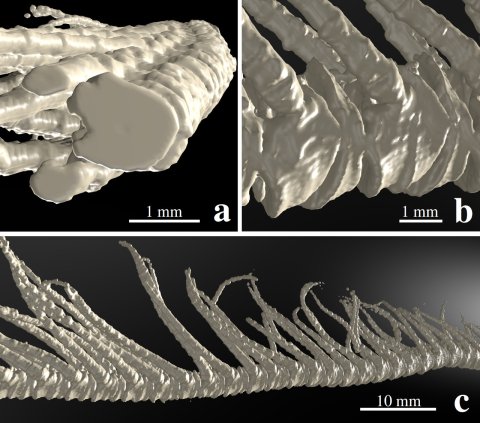
Abbildung 1: Computertomopraphische Aufnahme eines Arms des Haarsterns Promachocrinus kerguelensis. Abbildung a zeigt den fast kreisrunden Querschnitt der Armelemente, b die Seitenansicht der Armsegmente, den sogenannten Brachials, an denen seitlich die Pinnules sitzen. Die etwa zwei Zentimeter langen, haarartigen Strukturen können bei bedarf seitlich ausgeklappt oder entlang der Hauptachse des Arms angelehnt werden. In der Abbildung c ist ein etwa sechs Zentimeter langer Mittelteil des Arms dargestellt.
Video 3: Visualisierung des zugrundeliegenden mathematischen Modells eines schwimmenden Crinoidens P. kerguelensis, das die Grundlage für strömungsmechanische Berechnungen zur Bestimmung von Schubkraft, Schwimmgeschwindigkeit und Energieverbrauch bildete. Die Kinematik der Armbewegung wurde aus 53 Schlagzyklen spline-interpoliert und arithmetisch gemittelt; dazu mussten abweichende Größen und Zykluslängen der einzelnen Paddelschläge sowohl zeitlich als auch räumlich skaliert werden. Seine morphologische Form basiert auf einem Gleichungssystem, das aus den Größenverhältnissen von 8 Proben abgeleitet wurde. Die Bewegung der Fiederblättchen, der federartigen Strukturen an den Seiten der Arme, wurde auf der Grundlage der Schubberechnungen automatisiert. Während des Erholungsschlags, wenn ein Armsegment gegen die Schwimmrichtung angeströmt wird, werden die Fiederchen in Richtung der Armachse geneigt, um den Strömungswiderstand zu verringern. Beim Kraftschlag hingegen, der für Schub sorgt, werden die Fiederblättchen zur Seite gestreckt, um die effektive Fläche wie bei einem Paddel zu vergrößern.
Die Schwimmleistung von P. kerguelensis ergab dabei eine energieeffiziente Reisegeschwindigkeit von ~3 cm s-1 bei einem Energiebedarf von ~12 cal h-1, was, in Relation zum Körpergewicht gesetzt, ähnlich dem von schwimmenden Säugetieren ist. Ihr täglicher Grundbedarf beträgt zusätzlich ~3,5 cal day-1. Aus der Nettoprimärproduktion wurden Regionen mit ausreichendem Nahrungsvorkommen abgeleitet, die mindestens ihren Tagesbedarf decken. Die Vorhersagen stimmen sehr gut mit den Gebieten überein, an denen P. kerguelensis bisher gefunden wurde (Abb. 2). Produktivitätsanalysen über einen Zeitraum von sechzehn Jahren zeigen, dass eine zirkumantarktische Ausbreitung nur in sehr produktiven Jahren möglich ist. Basierend auf dieser Einschränkung führte das Modell zu einer zirkumantarktischen Ausbreitung in etwa 5.000 Jahren. Simulationen, die zu einer vollständigen Ausbreitung führten, erforderten jedoch aktives Schwimmen, eine jährliche Larvendrift von 75 Tagen und einen Ursprung in der Westantarktis. Die küstennahen Strömungen fördern eine westliche Ausbreitung, die im Weddellmeer endet. Zeitliche Variationen von reichen und mageren Jahren deuten auf einen fortlaufenden dynamischen Prozess hin, der empfindlich auf wechselnde Umgebungsbedingungen reagiert, wobei die zirkumantarktische Ausbreitung von P. kerguelensis seit der letzten Kältephase vor 15.000 Jahren dreimal stattgefunden haben könnte (Vid. 4).
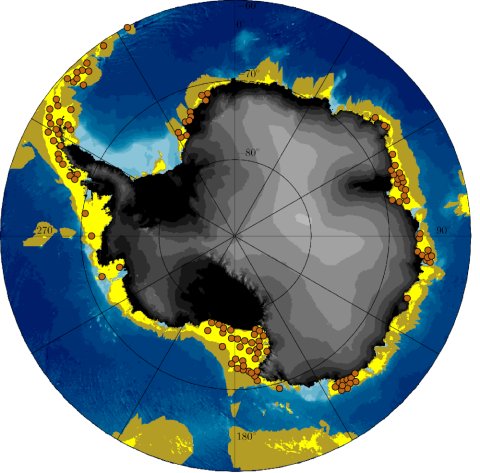
Abbildung 2: Stereopolare Projektion Süd 60° Süd basierend auf der IBCSO-Karte.[1] Die gelben Flächen repräsentieren das Gebiet, das langfristig die errechneten 3,5 Kalorien pro Tag liefert, die ein Promachocrinus kerguelensis zum Überleben und zur Arterhaltung benötigt. Dies bedeutet, dass ein Vorkommen der Haarsterne zumindest aufgrund der Nahrungsverfügbarkeit möglich ist. Die olivfarbenen Gebiete können theoretisch innerhalb von 75 Tagen durch Drift im Larvenstadium und ausgehend von einem Standort innerhalb des gelben Gebiets mit Hilfe von Meeres- und Gezeitenströmungen erreicht werden. Die braunen Punkte stellen dagegen die tatsächlichen Fundorte von P. kerguelensis dar.
Video 4: Migrationssimulation ausgehend von der Amundsen-See südwestlich der Antarktischen Halbinsel. Das zugrunde liegende Modell berücksichtigt Umweltparameter wie Meeres- und Gezeitenströmungen, das Nahrungsangebot in Form von verfügbarer Energie aus organischem Kohlenstoff und Stickstoff,[12] berechnet aus der Nettoprimärproduktion[13][14] an der Oberfläche, Wassertiefen[1] sowie artbezogene Merkmale, den Energiebedarf für den Ruhestoffwechsel, die Fortpflanzung und die Fortbewegung, wobei von einer Larvenphase von 75 Tagen ausgegangen wird,[15] während der sie mit den Strömungen im offenen Wasser driften. Die Simulation zeigt eine zirkumantarktische Ausbreitung in etwa 4000 Jahren.
References
[1] Arndt, J. E. et al. (2013). The International Bathymetric Chart of the Southern Ocean (IBCSO) Version 1.0-A new bathymetric compilation covering circum-Antarctic waters. Geophysical Research Letters, 40(12):3111–3117.
[2] Guensburg, T.E., Sprinkle, J., Mooi, R. et al. Sea Lilies in Spring: Crinoid Diversification during the Early Ordovician. Paleontol. J. 55, 985–992 (2021).
[3] Ameziane, N. and Roux, M. (1997). Biodiversity and historical biogeography of stalked crinoids (Echinodermata) in the deep sea. Biodiversity and Conservation, 6(11):1557–1570.
[4] Broyer, C. D. et al. (2014). Biogeographic atlas of the Southern Ocean. The Scientific Committee on Antarctic Research, Scott Polar Research Institute, Lensfield Road, Cambridge, CB2 1ER, United Kingdom. ISBN: 978-0-948277-28-3.
[5] Clark, A. H. (1967). A Monogrphy of the existing crinoids, Vol. 1, Part 5. Number 82 in Bulletin of the United States National Museum. U. S. government printing office, Washington.
[6] Hess, H., Ausich, W., Brett, C., Simms, M. J., and Taylor, W. L. (2003). Fossil Crinoids. Cambridge University Press.
[7] Oji, T., Ogawa, Y., Hunter, A. W., and Kitazawa, K. (2009). Discovery of dense aggregations of stalked crinoids in Izu-Ogasawara Trench, Japan. Zoological Science, 26(6):406–408.
[8] Meyer, D. L. (1985). Evolutionary implications of predation on recent comatulid crinoids from the Great Barrier Reef. Paleobiology, 11(2):154–164.
[9] Meyer, D. L. and Macurda, D. B. (1977). Adaptive radiation of the comatulid crinoids. Paleobiology, 3(1):74–82.
[10] Janevski, G. A. and Baumiller, T. K. (2009). Could a stalked crinoid swim? A biomechanical model and characteristics of swimming crinoids. Society for Sedimentary Geology, 25(9):588–596.
[11] Owsianowski, Nils et al. (2017): Sea-floor videos (benthos) along ROV profile PS82/128-1 during POLARSTERN cruise PS82, links to videos. Alfred Wegener Institute, Helmholtz Centre for Polar and Marine Research, Bremerhaven, PANGAEA, https://doi.org/10.1594/PANGAEA.879524.
[12] Platt, T. and Irwin, B. (1973). Caloric content of phytoplankton. Limnology and Oceanography, 8(2):306–310.
[13] Morel, A. (1991). Light and marine photosynthesis: A spectral model with geochemical and climatological implications. Prog. Oceanog., 26:263–306.
[14] Antoine, D. and Morel, A. (1996). Oceanic primary production 1. Adaptation of a spectral light-photosynthesis model in view of application to satellite chlorophyll observation. Global Biogeochemical Cycles, 10(1):43–55.
[15] McClintock, J. B. and Pearse, J. S. (1987). Reproductive biology of the common antarctic crinoid Promachocrinus kerguelensis (Echinodermata: Crinoidea). Marine Biology, 96(3):375–383.
last update: 21 Oct 2023 04:44
